
NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝。
(1)NH3催化氧化可制备硝酸。
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3__。
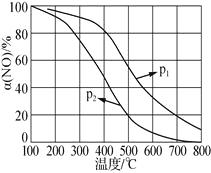
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如上图所示。则p1__p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是___。
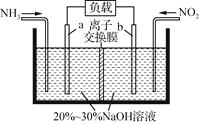
(2)利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为___ ;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为____mol。
(3)合成氨的原料气需脱硫处理。一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X。NaHS与NaVO3反应的化学方程式为____ 。
【答案】
(1)-1811.63 kJ·mol-1;>;NO2几乎完全分解
(2)2NO2+8e-+4H2O=8OH-+N2;0.15
(3)2NaHS+4NaVO3+H2O=Na2V4O9+2S↓+4NaOH
【解析】解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;
目标反应的反应热为:=1811.63 kJ•mol-1 ,
所以答案是:-1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;所以答案是:>;NO2几乎完全分解;
(2)(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1,所以答案是:CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2 , 所以被消除的NO2的物质的量为×0.2=0.15mol,所以答案是:2NO2+8e-+4H2O═8OH-+N2;0.15;
(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9 , 根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,所以答案是:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.